Современная медицина с каждым годом узнает все больше о генетических предпосылках онкологических заболеваний. Наука движется в сторону выявления и тщательного изучения мутаций, лежащих в основе рака. Теоретические наработки активно внедряют в практическую медицину, которая становится все более персонализированной. Новые методы позволяют подобрать для каждого пациента с онкопатологией максимально эффективное индивидуальное лечение с учетом особенностей течения именно его заболевания. Важную роль в этом играет комплексное геномное профилирование (КГП). Этот подход позволяет составить полную картину генетических изменений внутри каждой опухоли, и на основе биоинформационного анализа и экспертного мнения получить практические рекомендации по эффективному и безопасному лечению.
В этой статье мы разберем основные понятия, связанные с генетикой рака, поговорим о видах мутаций при опухолях и расскажем, как КГП помогает их обнаружить.
Биологическое разнообразие опухолей – проблема или решение?
Под общим термином «рак» в действительности понимают огромное количество заболеваний. Более того, злокачественный процесс в одном органе может иметь множество подтипов. Например, один только подтип рака легкого, который называют немелкоклеточным, может запускать мутации как минимум в 13 изученных генах – они составляют основные 2/3 «виновников» этой болезни. А сколько генов, вовлеченных в развитие этой болезни, еще не изучено1.
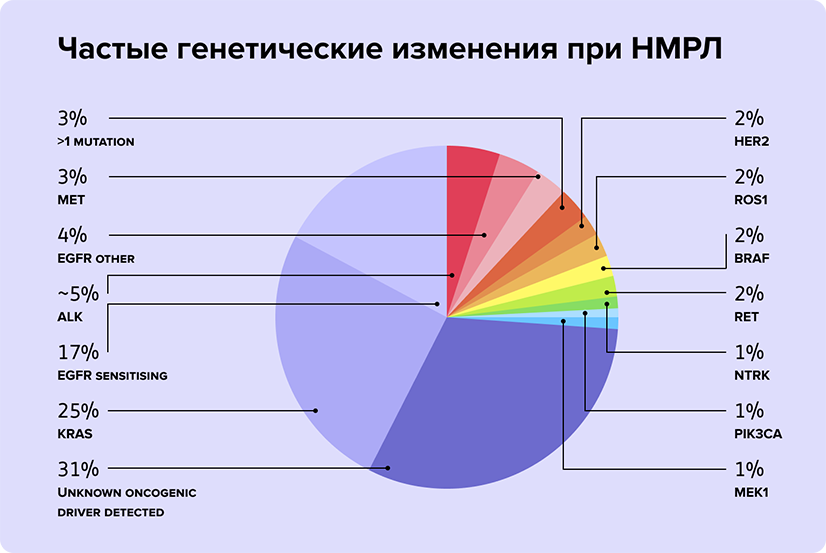
То есть существует множество молекулярных путей, сбой в которых приводит к тому, что нормальные клетки становятся злокачественными. Кроме того, в одной опухоли могут сочетаться разные мутации. С одной стороны, биологическое разнообразие опухолей – проблема, потому что нужно понять, какой вид заболевания у конкретного больного и из множества вариантов лечения выбрать оптимальный. С другой стороны, современные методы терапии позволяют прицельно воздействовать на конкретные молекулярные «поломки». И если точно подобрать «ключ», результат лечения будет очень хорошим.
Почему важно проводить геномное профилирование опухолей
Почему важно знать генетический профиль опухоли, связанные с ней мутации? Дело в том, что лечение рака очень усложнилось. В 2017 году в разработке находилось более 700 лекарственных молекул, действие которых направлено на разные пути образования опухолей2. Для подбора эффективного лекарства необходимо знать, какие именно генетические мутации есть в конкретном случае заболевания. Для этого проводят секвенирование – определение последовательностей «кирпичиков» (нуклеотидов), из которых состоит ДНК (генетический код) опухолевой клетки.
Секвенирование нового поколения расширяет возможности геномного профилирования опухолей
Передовой метод секвенирования нового поколения (NGS – next generation sequencing) дает возможность исследованием одного биоматериала провести комплексное геномное профилирование опухоли, т.е. обнаружить все возможные генетические изменения в большом количестве онкозначимых генов. При NGS происходит параллельное считывание миллионов мелких участков ДНК, их сравнение с эталонным геномом с помощью биоинформатического анализа.
Если с помощью прежних методов, таких как полимеразная цепная реакция (ПЦР), иммуногистохимическое исследование (ИГХ) или флуоресцентная гибридизация in situ (FISH) можно было исследовать изменения в одном или нескольких генах, то NGS позволяет исследовать практически весь геном за один раз3, 4.
Комплексное геномное профилирование - подход, объединяющий новейшие методы диагностики и лечения рака
С помощью КГП можно проанализировать все классы генетических изменений во всех известных онкозначимых генах. Таким образом, значительно повышается точность выявления мутаций в генах и определения типа опухоли. Так, КГП позволяет выявить до 37% больше пациентов с изменениями в генах при меланоме и до 35% больше при некоторых видах рака легкого по сравнению с методами ПЦР, ИГХ, FISH и другими традиционными методами5–7. Существуют тесты, позволяющие определить изменения (мутации) в 324 генах, связанных с раком.
КГП обеспечивает сопроводительную диагностику — дает информацию для безопасного и эффективного использования соответствующего лечения.
То есть, проведя один тест, можно оценить изменения во всех генах, которые рекомендуют проверять на мутации. Такое геномное профилирование опухоли помогает выбрать самый подходящий в конкретном случае вариант лечения8, 9. Современные методы лечения избирательно действуют на конкретные звенья процесса образования опухоли, благодаря этому можно точно «бить в цель» (таргетное воздействие, иммунотерапия), уничтожая только злокачественные клетки.
Какие ткани подходят для исследования КГП?
Для проведения тестирования подходят кусочки тканей опухоли, полученные при биопсии или во время операции. В случаях, когда биопсия ткани невозможна, или образца ткани недостаточно для анализа, можно использовать венозную кровь.
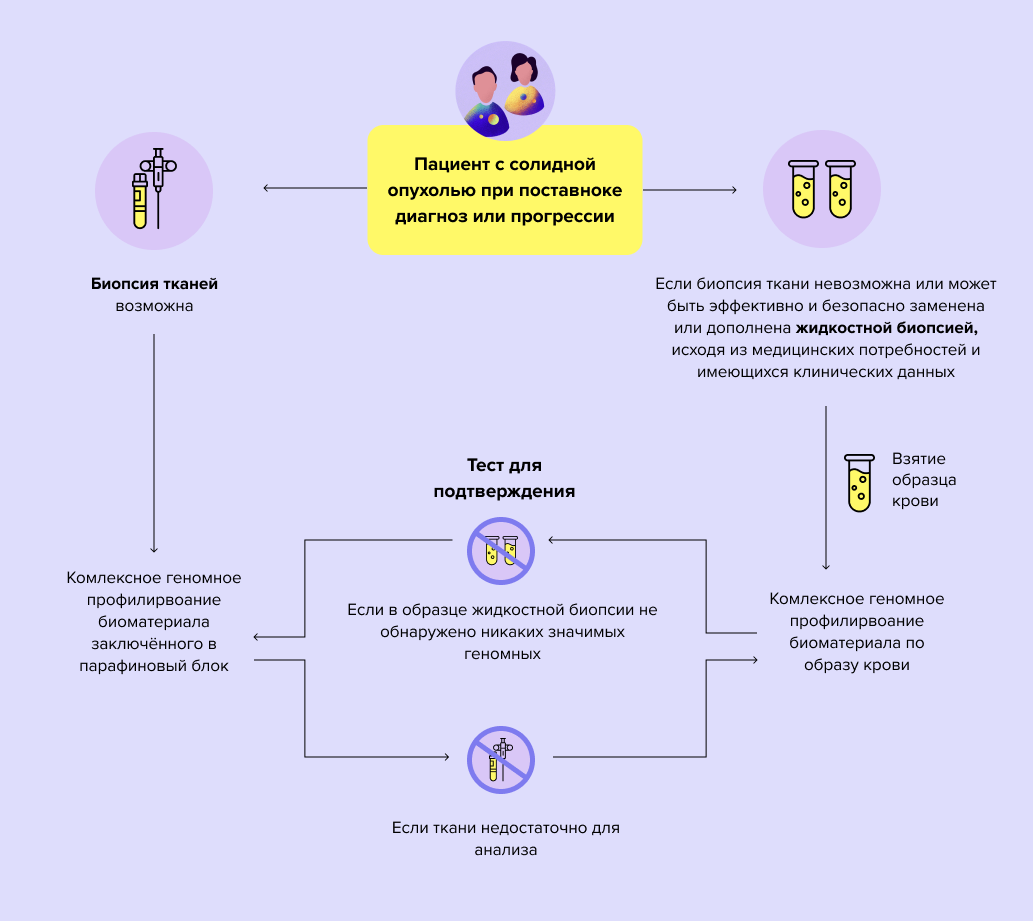
Кому показано проводить комплексное геномное профилирование?
В целом КГП показано для пациентов:
- с любым видом злокачественного новообразования III–IV стадии
- и/или при опухолях, устойчивых к терапии
- и/или при рецидивирующих опухолях
- и/или при метастатических формах рака
Особенно важно КГП для пациентов с опухолями невыявленной первичной локализации (ОНПЛ) и большой генетической разнородностью.
Как устроена система тестирования КГП
Комплексное геномное профилирование может состоять из нескольких этапов10, 11:
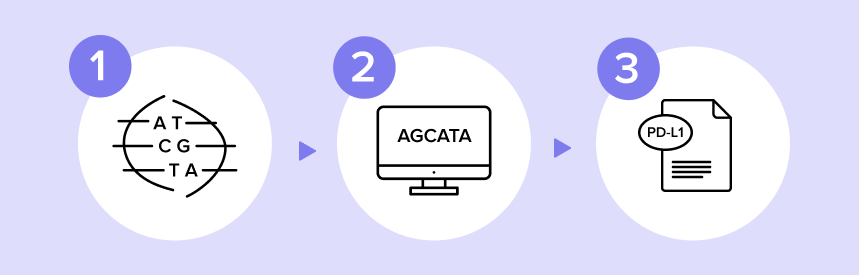
- Образцы исследуют на все клинически значимые генетические изменения с помощью секвенирования нового поколения NGS.
- Данные структурируют и получают практический результат с помощью биоинформационного анализа.
- Формируется подробный отчет с информацией о геномных изменениях в опухоли конкретного пациента и возможных персональных терапевтических подходах и вариантах таргетного лечения.
Каковы преимущества КПГ?
Инновационный метод геномного профилирования12:
- Комплексно оценивает все основные классы изменений в сотнях онкозначимых генах.
- Имеет высокую чувствительность и специфичность для ключевых геномных изменений.
- Комплексная панель подобрана на основании ведущих и проверенных в клинической практике научных рекомендаций, а также подтверждается биоинформатическим анализом.
- Итоговый подробный отчет дает четкое представление о геномном профиле опухоли пациента и позволяет подобрать ему персонализированное лечение.
- Быстрый ответ: от момента получения образца до отправки отчета врачу проходит менее двух недель.
Заключение
Современные научные достижения позволяют выявлять все типы молекулярных изменений в опухоли с высокой точностью. В результате врачи получают уникальный генетический профиль опухоли у каждого конкретного пациента. Благодаря этому они могут поставить точный диагноз, определить прогноз и выбрать оптимальное лечение, подходящее именно этому пациенту, то есть максимально индивидуализировать терапию. Комплексное геномное профилирование – инновационный подход, объединяющий в клинической практике новейшие методы диагностики, биоинформационный анализ и ведущих экспертов, чтобы каждый человек с онкологическим диагнозом мог получить лечение, которое подходит именно ему и даст максимально эффективный результат.
В следующей статье мы расскажем о видах мутаций и о том, при каких заболеваниях они могут встречаться.
M-RU-00009606 Март 2023
Источники
- Tsao AS, Scagliotti GV, Bunn Jr PA. J Thorac Oncol. 2016 May;11(5):613-638. doi: 10.1016/j.jtho.2016.03.012.
- Global Oncology Trends Report 2018. Report by IQVIA Institute for Human Data Science. Электронный ресурс.https://www.iqvia.com/-/media/iqvia/pdfs/institute-reports/global-oncology-trends-2018.pdf (дата обращения: 11.10.2022).
- Murakami Y, et al. Front. Oncol 2012 https://doi.org/10.3389/fonc.2012.00024.
- Illumina sequencing. Электронный ресурс. https://www.ebi.ac.uk/training/online/course/ebi-next-generation-sequencing-practical-course/what-next-generation-dna-sequencing/illumina- (дата обращения: 11.10.2022).
- Boussemart L. et al. Annals of Oncology. 2017; 28 (suppl_5): v428-448.
- Ali SM., et al. (2016) Oncologist 21:762-70.
- Schrock, AB., et al. (2016) Clin Cancer Res 22:3281-5.
- Rotter J, Wilson L, Greiner MA et al. Shared-Patient Physician Networks and their Impact on the Uptake of Genomic Testing in Breast Cancer. Breast Cancer Res Treat. 2019 Jul; 176(2): 445–451. Published online 2019 Apr 26. doi: 10.1007/s10549-019-05248-2.
- FoundationOne CDx Press Release. FDA companion diagnostic approval. Электронный ресурс. https://www.foundationmedicine.com/press-releases/f2b20698-10bd-4ac9-a5e5-c80c398a57b5 (дата обращения: 11.10.2022).
- Beaubier N, Bontrager M, Huether R et al. Integrated genomic profiling expands clinical options for patients with cancer. Nature Biotechnology. 2019;37: 1351–1360.
- Torres GF, Bonilla CE, Buitrago G et al. How clinically useful is comprehensive genomic profiling for patients with non-small cell lung cancer? A systematic review. Crit Rev Oncol Hematol. 2021;166:103459. doi: 10.1016/j.critrevonc.2021.103459.
- Woodhouse R. et al. Clinical and analytical validation of FoundationOne Liquid CDx, a novel 324-Gene cfDNA-based comprehensive genomic profiling assay for cancers of solid tumor origin. PLoS One. 2020; 15(9): e0237802. doi: 10.1371/journal.pone.0237802.