Время прочтения: 11 минут
Содержание:
- Виды хирургического лечения при раке молочной железы
- В каких случаях выполняют органосохраняющее хирургическое лечение?
- Кому показана неоадъювантная терапия и кому она нужна?
- Выбор вида хирургического лечения
- Может ли удаление всей молочной железы исключить рецидив заболевания?
- Если нет разницы, то какую операцию выбрать?
Заболевание любым видом рака — всегда тяжелый стресс для человека. При злокачественной опухоли молочной железы он может усугубляться проблемами эстетического характера, связанными с восприятием своего нового образа, что затрудняет для женщины выбор лечения. В эпоху расцвета пластической хирургии, когда популярны операции по увеличению груди, многие женщины с раком молочной железы (РМЖ) часто идут на полное удаление органа. Пройдя шок и все психологические фазы принятия диагноза, многие все же выбирают наибольшие по объему хирургические вмешательства, считая их более эффективными. Всегда ли это оправданно? Как оказалось, не всегда удалить больше ткани — лучше.
Органосохраняющие операции позволяют сохранить здоровую ткань, легче переносятся, косметические результаты после них лучше. Такие хирургические методы стали использовать чаще после введения в практику неоадъювантной терапии, которая уменьшает размер опухоли, а значит, снижает объем хирургического вмешательства. Однако все еще распространено мнение о том, что при полном удалении молочной железы — мастэктомии — шансов на выздоровление больше. Данные многочисленных современных исследований опровергают это1–3.
Виды хирургического лечения при раке молочной железы
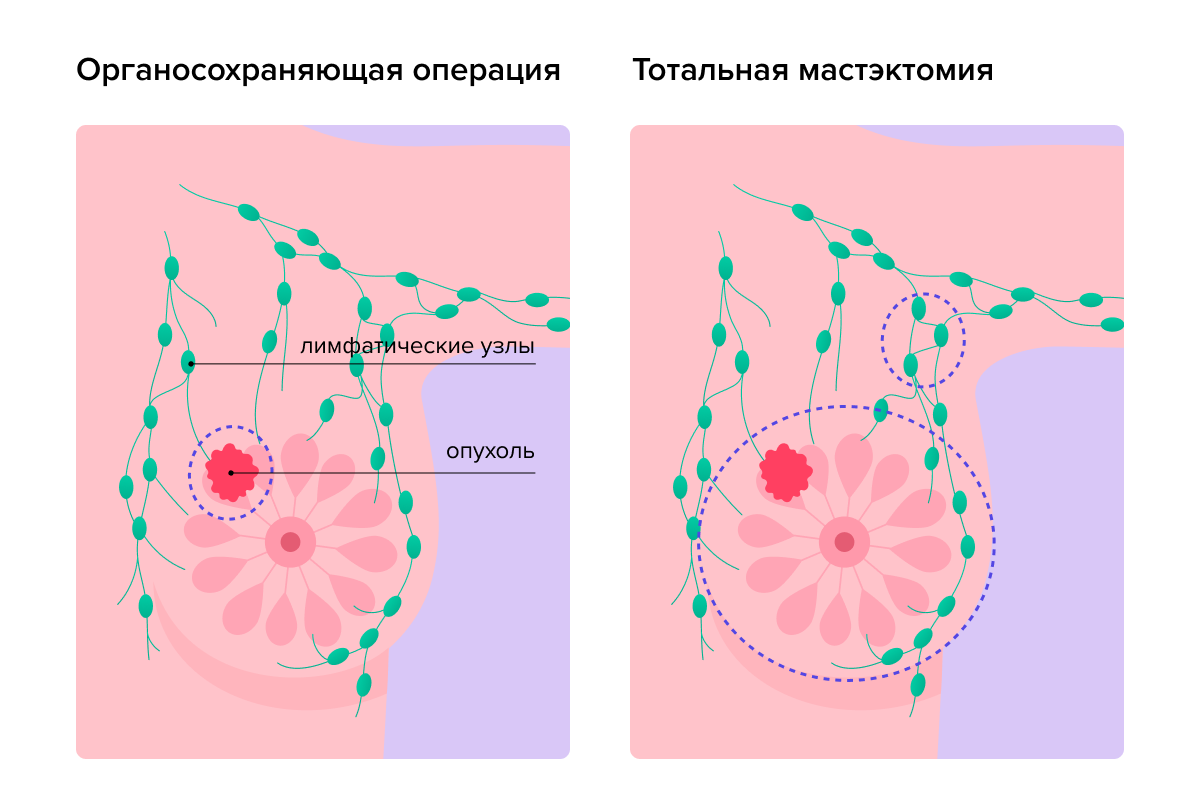
Операция — один из основных методов лечения неметастатического РМЖ. Если метастазы еще не образовались, врачи говорят о локальном процессе, то есть они могут установить границы опухоли и удалить ее целиком4. Если не углубляться в детали, то хирург выполняет один из двух типов операций — мастэктомию или органосохраняющую5.
Мастэктомия
Мастэктомией называют хирургическое вмешательство, при котором молочную железу удаляют полностью.
В первоначальном варианте вместе с пораженным органом хирурги убирали большой объем прилежащих тканей: грудные мышцы, лимфатические узлы, кожу, сосок, что приводило к значительной травматизации с косметическими дефектами. Теперь грудные мышцы убирают только при их метастатическом поражении, при небольших размерах образования возможно сохранение кожи и соска6. Во время мастэктомии или после нее врачи могут провести реконструкцию грудными имплантатами, добиться хороших эстетических результатов и вернуть красоту тела7.
Во время хирургического лечения с сохранением молочной железы удаляют только ее пораженную злокачественной опухолью часть. В зависимости от размера новообразования хирург может использовать разные методики.
Лампэктомия
Минимальное вмешательство происходит при лампэктомии — прицельном удалении злокачественного новообразования, при котором минимально затрагиваются прилежащие ткани.
Секторальная резекция
Если размер опухоли требует более широкого вмешательства, хирург удалит сектор молочной железы — участок треугольной формы, обращенный вершиной к соску, что называется секторальной резекцией.
Хирургические вмешательства с сохранением молочной железы и естественной формы груди лучше сохраняют качество жизни8.
Регионарные лимфатические узлы расположены вблизи молочной железы и зачастую становятся первым местом куда метастазирует опухоль.
На этапе диагностики врачи тщательно исследуют их. Если в лимфоузлах появились метастазы, то объем хирургического лечения увеличивается. Удаление лимфатических узлов называется лимфаденэктомией. Она может проводиться в дополнение к мастэктомии и органосохраняющим операциям при наличии подтвержденного опухолевого поражения лимфатических узлов9.
В каких случаях выполняют органосохраняющее хирургическое лечение?
При стадиях I, II и IIIA (Т3N1М0) лечение РМЖ может быть начато с операции. Объем хирургического вмешательства определяет хирург в зависимости от типа опухоли, ее расположения, соотношения размера опухоли к объему молочной железы, общего состояния пациентки4. При большом размере опухоли, вовлечении лимфатических узлов, неблагоприятном расположении выполняется мастэктомия. При небольших опухолях, отсутствии метастазов в лимфатических узлах возможно выполнение как малоинвазивных органосохраняющих операций, так и мастэктомии.
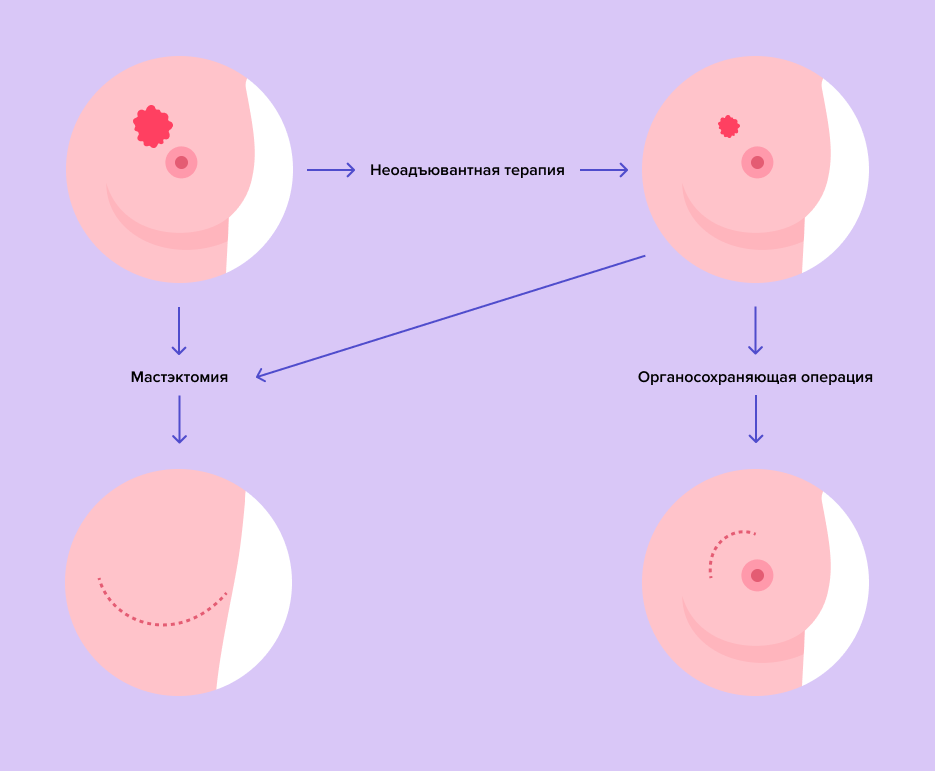
Пациенты с РМЖ стадий IIIA (кроме T3N1M0), IIIB, IIIC считаются первично неоперабельными — им невозможно выполнить оперативное вмешательство при имеющейся распространенности процесса. В таких случаях врачи сначала назначают лечение, чтобы уменьшить размеры опухоли и стадию заболевания, потом — выполняют операцию. Такая предоперационная терапия называется неоадъювантной.
Кому показана неоадъювантная терапия и зачем она нужна?
Врачи-онкологи часто в дополнение к хирургии используют системную терапию — внутривенное введение лекарственных препаратов, которые уничтожают раковые клетки во всем организме. Если такое лечение проводят до операции, оно называется неоадъювантным, если после — адъювантным. При РМЖ оба этих подхода одинаково эффективно снижают вероятность рецидива (возвращения заболевания) и увеличивают продолжительность жизни4.
С неоадъювантной терапии начинается лечение первично неоперабельного РМЖ стадий IIIA (кроме T3N1M0), IIIB, IIIC. Лекарственные препараты помогают уменьшить размер основного новообразования и устранить поражение лимфатических узлов.
Благодаря такому подходу в 80% случаев опухоль переходит в категорию операбельных10.
В дополнение к хирургическому лечению адъювантную и неоадъювантную терапии могут назначить пациентам с операбельным раком стадий IIА (T2N0M0), IIВ (T2N1M0, T3N0M0), IIIA (T3N1M0). Выбор алгоритма зависит от конкретной клинической ситуации. Основной целью такого лечения является уничтожение микрометастазов — отдельных опухолевых клеток, вышедших за границы опухоли. Именно они могут в дальнейшем привести к рецидиву заболевания. Однако неоадъювантную терапию врачи используют также для уменьшения размеров злокачественного новообразования, чтобы сохранить как можно большую часть молочной железы.
Исследования показывают, что у 50% пациентов неоадъювантная терапия делала возможным проведение органосохраняющего вмешательства вместо мастэктомии11.
Важное преимущество неоадъювантной терапии — врачи уже на ранних этапах лечения понимают, эффективны ли выбранные лекарственные препараты против рака. Если во время неоадъювантной терапии размеры опухоли уменьшились, такое лечение можно продолжить и после хирургического лечения для снижения риска рецидива. А если оно не помогло, то врачи после операции подберут другие препараты. Особенно это важно при тройном негативном и HER2 положительном РМЖ, для которых характерны агрессивное течение и неблагоприятный прогноз. Если у таких пациентов размер опухоли превышает 2 см или поражены подмышечные лимфатические узлы, то врачи начинают лечение с неоадъювантной терапии12.
При агрессивных подтипах РМЖ, таких как тройной негативный или HER2-позитивный, неоадъювантную терапию проводят, начиная со II стадии. Такой подход позволяет понять, насколько эффективно выбранное лечение и, при необходимости, скорректировать его после операции, тем самым дополнительно снижая риск рецидива (см. рисунок ниже).
Выбор вида хирургического лечения
При раннем РМЖ возможно проведение как мастэктомии, так и органосохраняющей операции. Выбор метода зависит от клинической ситуации, предпочтений врача и пациентки. До введения в практику неоадъювантной терапии органосохраняющие вмешательства проводили только в 35% случаев8. Сегодня врачи используют лекарственную и лучевую терапии, чтобы уменьшить размер опухоли и максимально сохранить здоровые ткани.
Может ли удаление всей молочной железы исключить рецидив заболевания?
Еще в начале 1980-х крупные рандомизированные исследования доказали, что органосохраняющая хирургия с последующей послеоперационной лучевой терапией так же эффективна, как и мастэктомия у женщин с ранним РМЖ13. По некоторым данным, результаты лечения у пациенток после органосохраняющих операций с последующей лучевой терапией даже лучше. Исследование, проведенное в Швеции с участием 2756 женщин, страдающих РМЖ, показало, что вероятность развития рецидива при таком лечении была ниже, а выживаемость выше, чем при мастэктомии без лучевой терапии14. Причина может быть в том, что послеоперационная лучевая терапия дополнительно уничтожает оставшиеся раковые клетки, а также может вызывать активацию иммунной системы для борьбы с опухолевыми клетками15.
Если нет разницы, то какую операцию выбрать?
1. Нужно понять, есть ли у вас выбор.
Даже при раннем РМЖ есть медицинские причины, ограничивающие возможности для органосохраняющей операции. Врач соотносит размеры опухоли с объемом молочной железы, определяет ее расположение, учитывает состояние здоровья пациентки и на основе этого определяет, возможно ли безопасно удалить образование с желаемым косметическим результатом15.
2. Готовы ли вы к лучевой терапии после хирургического лечения?
Лучевую терапию после операций с сохранением молочной железы проводят обязательно. Лечение обычно хорошо переносится. Чаще всего после процедуры могут возникать покраснения кожи, появляется утомляемость. В течение нескольких недель после завершения лучевой терапии эти симптомы исчезают. Поздние осложнения, такие как перелом ребер, лучевой пневмонит, вторичные злокачественные новообразования, встречаются редко16.
Если вы задумываетесь о таком лечении, будьте готовы ежедневно посещать кабинет лучевой терапии. Лечение начинается через 4–12 недель после удаления опухоли, проводится ежедневно 5 дней в неделю на протяжении нескольких недель. При беременности, ряде аутоиммунных заболеваний лучевая терапия может быть противопоказана. Если женщина не готова к лучевой терапии, то единственным решением становится мастэктомия.
3. Хотите ли вы сохранить грудь?
Обсудите с доктором возможность сохранить молочную железу. У большинства женщин при таком лечении достигается хороший косметический результат17. При мастэктомии хирурги также выполняют реконструкцию грудными имплантатами, но чувствительность в области груди теряется, что снижает качество жизни18.
4. Готовы ли вы к повторным операциям?
При органосохраняющей операции хирург иссекает опухоль в пределах здоровых тканей. После ее завершения и исследования биологического материала может оказаться, что не все образование было удалено, тогда потребуется повторное хирургическое вмешательство.
5. Насколько вы готовы к большой операции?
При мастэктомии объем вмешательства больше, может потребоваться реконструкция груди на следующем этапе лечения. Все это удлиняет процесс выздоровления. Кроме того, при хронических заболеваниях, таких как сахарный диабет, ожирение, процесс восстановления после лечения дольше, выше риск послеоперационных осложнений.
6. Насколько вы будете беспокоиться о возвращении рака молочной железы?
Если, несмотря на доказательства высокой эффективности органосохраняющей операции, страх рецидива болезни все же не покидает, обсудите с врачом возможность проведения мастэктомии.
В таблице ниже приведены важные моменты, которые следует учитывать при выборе между мастэктомией и органосохраняющей операцией в сочетании с лучевой терапией.

Ответив себе на вопросы и узнав сильные и слабые стороны этих двух подходов, обсудите со своим лечащим врачом, что предпочтительнее, и примите решение с учетом его рекомендации. Помните, что у вас всегда остается возможность получить второе мнение у другого специалиста.
M-RU-00012498 Июль 2023
Источники
- Blichert-Toft M., et al. Long-term results of breast conserving surgery vs. mastectomy for early stage invasive breast cancer: 20-year follow-up of the Danish randomized DBCG-82TM protocol. Acta oncologica. 2008;47(4):672–681.
- de Boniface J., et al. Survival After Breast Conservation vs Mastectomy Adjusted for Comorbidity and Socioeconomic Status: A Swedish National 6-Year Follow-up of 48 986 Women. JAMA surgery. 2021 Jul 1;156(7):628–637.
- van der Noordaa Marieke EM, et al. Breast-Conserving Therapy in Patients with cT3 Breast Cancer with Good Response to Neoadjuvant Systemic Therapy Results in Excellent Local Control: A Comprehensive Cancer Center Experience. Annals of Surgical Oncology. 2021:1–12.
- Клинические рекомендации Минздрава РФ. Рак молочной железы. 2021.
- Czajka M.L., Pfeifer C. Breast cancer surger. StatPearls [Internet]. StatPearls Publishing, 2022.
- Малыгин С.Е. Мастэктомия: рождение, эволюция и современное значение в лечении и профилактике рака молочной железы. Злокачественные опухоли. 2015;4:3–13.
- Regan J.P., Schaffner A.D. Breast reconstruction expander implant. StatPearls [Internet]. StatPearls Publishing. 2022.
- Sun Z.H., et al. Breast surgery for young women with early-stage breast cancer: Mastectomy or breast-conserving therapy? Medicine. 2021.
- Toomey A., Lewis C.R. Axillary Lymphadenectomy StatPearls [Internet]. StatPearls Publishing. 2022.
- Moo T. A. et al. Overview of breast cancer therapy. PET clinics. 2018;13(3):339–354.
- Golshan M. et al. Breast conservation after neoadjuvant chemotherapy for triple-negative breast cancer: surgical results from the BrighTNess randomized clinical trial. JAMA surgery. 2020;155(3): e195410–e195410.
- Harbeck N. Neoadjuvant and adjuvant treatment of patients with HER2-positive early breast cancer. The Breast. 2022;62:12–16.
- Corradini S., et al. Mastectomy or breast-conserving therapy for early breast cancer in real-life clinical practice: outcome comparison of 7565 cases. Cancers. 2019;11(2):160.
- De Boniface J., et al. Breast-conserving surgery followed by whole-breast irradiation offers survival benefits over mastectomy without irradiation. Journal of British Surgery. 2018;105(12):1607–1614.
- Jordan R.M., Oxenberg J. Breast Cancer Conservation Therapy. 2019.
- Wang W. Radiotherapy in the management of early breast cancer. Journal of medical radiation sciences. 2013;60(1):40–46.
- Admoun C., Mayrovitz H., Mayrovitz H.N. Choosing mastectomy vs lumpectomy-with-radiation: experiences of breast cancer survivors. Cureus. 2021;13(10).
- Bijkerk E., et al. Breast sensibility after mastectomy and implant-based breast reconstruction. Breast Cancer Research and Treatment. 2019:175: 369–378.




