Время прочтения: 14 минут
Содержание:
- Типы РМЖ и возможность использования таргетной терапии
- Люминальные типы РМЖ
- HER2-положительный РМЖ
- Тройной негативный РМЖ
- Типы таргетных препаратов, используемых при РМЖ
- Как работает анти-HER2 терапия?
- Таргетная терапия трижды негативного рака молочной железы
Достижения молекулярной биологии последней четверти XX века позволили ученым выявить механизмы, регулирующие размножение и естественную гибель клеток. Эти открытия легли в основу нового направления в борьбе со злокачественными новообразованиями — таргетную терапию (от английского target — мишень). В отличие от химиотерапии, действующей неизбирательно на здоровые и опухолевые клетки, таргетные препараты действуют через конкретную молекулярную мишень на клетки рака. Поэтому безопасность этого вида лечения выше.
Рак молочной железы (РМЖ) — одно из первых онкологических заболеваний, для которого ученые описали молекулярную мишень, через которую можно воздействовать на клетки опухоли и подавлять их. Гормональная терапия появилась еще в 70-х годах XX века, а спустя 20 лет был зарегистрирован первый ингибитор HER2. С тех пор таргетная терапия при раке непрерывно развивается, и сейчас в распоряжении онкологов есть новые препараты с различными механизмами действия1.
Типы РМЖ и возможность использования таргетной терапии
Злокачественные опухоли молочной железы отличаются друг от друга строением раковых клеток и наличием на их поверхности рецепторов.
Рецепторы — это специальные белковые молекулы, передающие клетке сигналы к конкретным «действиям». Чтобы определить тип РМЖ, врачи оценивают наличие или отсутствие трех рецепторов: двух к половым гормонам — эстрогенам и прогестерону, а также рецепторов эпидермального фактора роста 2-го типа, или HER2.
На сегодняшний день в зависимости от состава рецепторов и специального показателя, отражающего насколько быстро делятся раковые клетки, выделяют четыре типа РМЖ: люминальный А, люминальный B, HER2-позитивный и тройной негативный2.
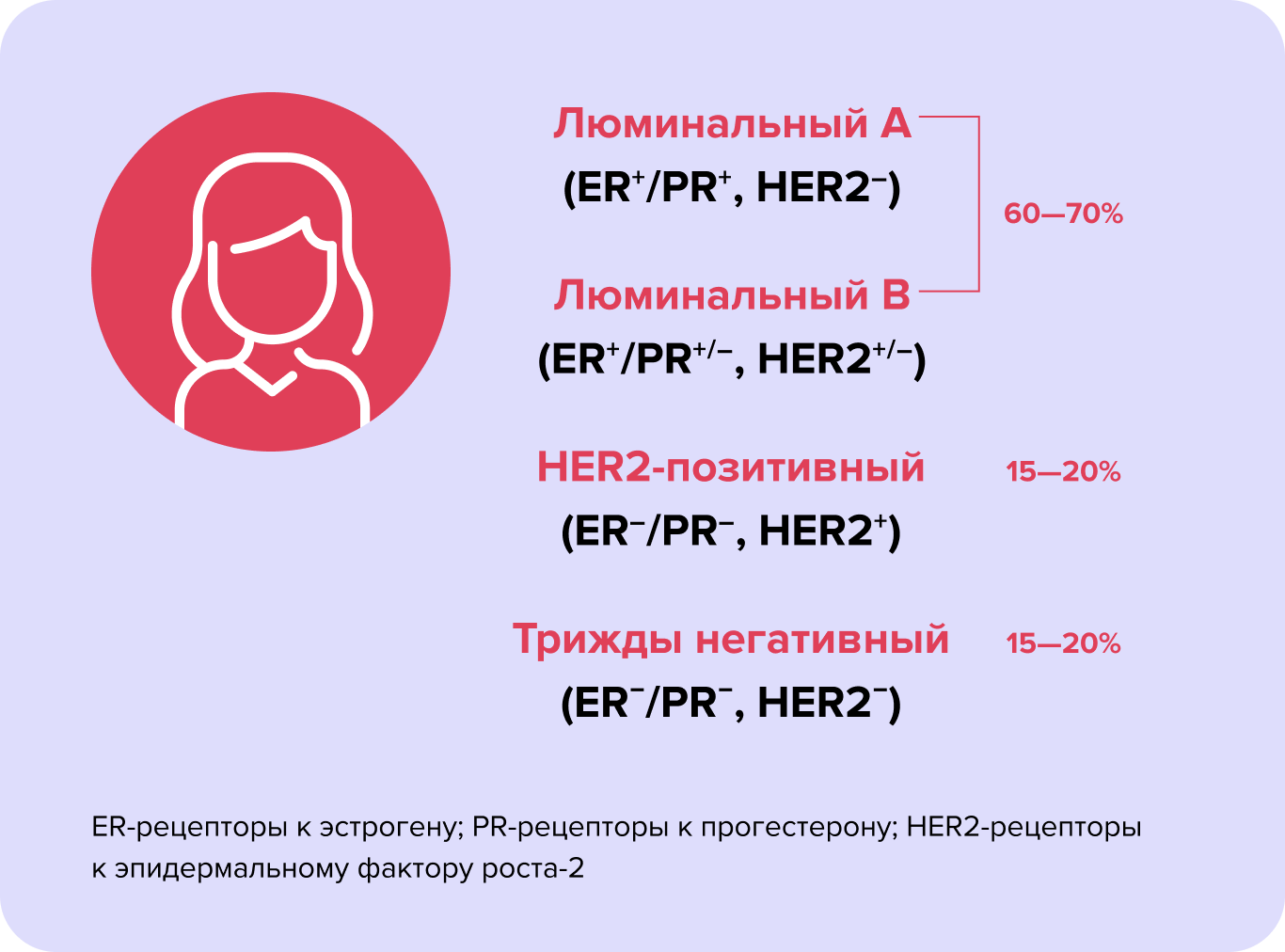
Рис. 1. Молекулярные подтипы РМЖ3
Люминальные типы РМЖ
Люминальный рак А — самый распространенный тип опухолей молочной железы. При таком варианте в злокачественных клетках определяются рецепторы к половым гормонам — эстрогенам и прогестерону, а вот рецепторов к HER2 нет. Очень похож на него люминальный рак B, в клетках которого также есть рецепторы к половым гормонам. Он отличается от первого более быстрыми темпами роста. Об этом говорит повышенная скорость деления клеток (измеряется показателем Ki-67). Люминальный рак встречается в 60–70% случаев РМЖ.
Половые гормоны, соединяясь с рецепторами на поверхности опухолевых клеток, передают им сигнал, который заставляет клетки расти и размножаться в ускоренном темпе. Поэтому при обнаружении в образце опухоли рецепторов к эстрогену и прогестерону врач назначает гормональную терапию1. Ее цель — исключить стимулирующее влияние гормонов на опухолевую клетку. Гормонотерапия применяется у всех пациенток с люминальным раком молочной железы. На ранних стадиях онкологи назначают ее после операции для снижения частоты рецидивов. При метастатическом раке гормональная терапия является основным лечением4.
Иногда при люминальном раке В обнаруживаются рецепторы к HER2, тогда в дополнение к гормональной терапии добавляют анти-HER2 препараты.
HER2-положительный РМЖ
При HER2-положительном РМЖ опухолевые клетки имеют на своей мембране рецептор эпидермального фактора роста 2-го типа (HER2), а вот рецепторов к половым гормонам у них нет. В норме рецептор HER2 в небольших количествах обнаруживается на эпителиальных клетках кожи, слизистых оболочек, протоков молочной железы. Он получает сигналы от факторов роста, после чего запускает деление клетки и выключает механизм самоуничтожения — апоптоза. У некоторых злокачественных клеток рецепторов HER2 становится слишком много, что «вынуждает» их постоянно расти и делиться. На этот тип РМЖ приходится примерно 15–20% случаев. Заболевание отличается агрессивностью, высокой скоростью роста и появления метастазов5.
В лечении пациенток с HER2-позитивным РМЖ активно используют таргетную анти-HER2 терапию. При I стадии ее применяют после операции, на II и III стадиях — как до операции так и после. Когда хирургическое лечение невозможно из-за неоперабельности опухоли или образования метастазов, анти-HER2 становится основой лекарственного лечения.
Гормональную терапию у пациентов с HER2-положительным РМЖ не применяют, поскольку рецепторы к половым гормонам отсутствуют.
Тройной негативный РМЖ
Тройной негативный РМЖ обнаруживается у 15–20% женщин с раком молочной железы2. При этом варианте опухолевые клетки не имеют ни рецепторов половых гормонов, ни HER2. Это делает их нечувствительными к гормональным и анти-HER2 препаратам. Долгое время единственным способом лечения пациенток с тройным негативным РМЖ оставалась химиотерапия.
Однако выяснилось, что у каждой четвертой женщины с тройным негативным раком в опухолевых клетках обнаруживается мутация генов BRCA 1 и 2. Это генетическое нарушение передается по наследству и вызывает рак молочной железы и рак яичников. У таких пациенток врачи применяют таргетные препараты — ингибиторы PARP. Для их назначения необходимо провести молекулярно-генетический анализ опухолевых клеток.
Типы таргетных препаратов, используемых при РМЖ
Гормональная терапия
О роли половых гормонов в развитии рака молочной железы ученые стали говорить с конца XIX века. Хирург из Эдинбургского колледжа Джордж Битсон изучал связь между яичниками и молочными железами. Он заметил, что у кроликов после удаления яичников переставало выделяться молоко. Это говорило о том, что яичники каким-то образом регулируют работу молочных желез. Только спустя несколько лет выяснится, что связь этих органов осуществляется с помощью гормонов. Но, не зная в то время об эстрогенах, Битсон начал удалять яичники пациенткам с распространенным раком молочной железы. Он понял, что присутствие в этой цепи какого-то элемента имеет решающее значение для роста некоторых видов рака молочной железы и что удаление яичников — основного источника эстрогенов, как позднее выяснится, — является успешным противораковым лечением. Сегодня врачи могут блокировать половые гормоны, не прибегая к операции по удалению яичников. Для этого они используют лекарственные препараты с несколькими механизмами действия.
- Блокирование рецепторов эстрогена в раковых клетках с помощью селективных модуляторов. Они связываются с рецепторами и не дают эстрогену присоединиться к ним. Лечение может применяться в том числе у женщин, у которых еще не наступила менопауза.
- Разрушение рецепторов эстрогена с помощью селективных ингибиторов.
- Снижение выработки гормонов. Женские половые гормоны синтезируются из мужских под действием фермента ароматазы. Препараты, блокирующие этот процесс, называются ингибиторами ароматазы. Они более эффективны, чем антагонисты эстрогена, но назначать их можно только женщинам с нефункционирующими яичниками3 в постменопаузе. У молодых женщин при высокоактивном заболевании, когда ингибиторы ароматазы необходимы для лечения опухоли, требуется искусственное «отключение» яичников. Это можно сделать хирургически или с помощью высоких доз гормонов4.
Гормональные препараты для лечения рака молочной железы можно назвать прототипами современных таргетных препаратов из-за их ориентированности на конкретную молекулярную цель6.
Моноклональные антитела
Блокирование рецепторов HER2 — первый способ, разработанный для борьбы с HER2-положительным РМЖ. Для этого применяют моноклональные антитела, связывающиеся с рецептором и прерывающие путь передачи сигнала3.
Ингибиторы тирозинкиназы
Активация некоторых рецепторов может вызвать бесконтрольное деление и развитие опухоли.
Как прервать этот сигнал? Нужно отключить рецептор или уничтожить сам сигнал, как происходит в случае гормональной терапии или блокирования HER2-рецепторов моноклональными антителами. Однако после начала применения таких препаратов выяснилось, что в некоторых случаях они неэффективны. Кроме того, со временем опухолевые клетки могут приобретать устойчивость к препаратам, из-за чего заболевание прогрессирует.
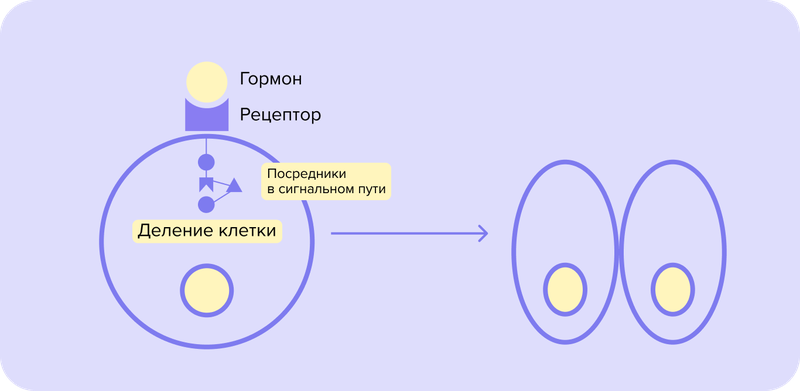
Дело в том, что сигнал, пришедший на рецептор, должен пройти еще через несколько посредников, чтобы вызвать реакцию клетки.
Давайте представим офис. Директору пришло важное письмо о том, что ему нужно срочно организовать несколько новых филиалов. Но информация не попадает к нему напрямую. Сначала конверт получает сотрудник отдела входящих заявок, оттуда он отправляется в отдел безопасности, потом к заместителю, секретарю и так далее. При этом, если хоть один сотрудник окажется недостаточно компетентным или будет иметь злой умысел, письмо может затеряться или информация в нем будет искажена.
В клетке существует такая же цепочка передачи сигнала, включающая несколько участников, чаще всего они представлены ферментами тирозинкиназами. Рак часто развивается из-за повреждения тирозинкиназ, в результате чего они становятся постоянно активными. В этой ситуации они ведут себя как секретарь, обманывающий директора, — заставляют клетку делиться, даже если сигнала об этом не поступало.
Ингибиторы тирозинкиназ — класс лекарственных препаратов, которые прицельно блокируют эти ферменты. При раке молочной железы врачи научились прерывать несколько сигнальных путей7.
Ингибиторы HER2
Как и моноклональные антитела, препараты этого класса используют для подавления сигнального пути HER2. Однако воздействуют они иначе — не блокируют сам рецептор, а нарушают его функционирование. Таким образом, даже если фактор роста связывается с рецептором, дальнейшей передачи сигнала не происходит8.
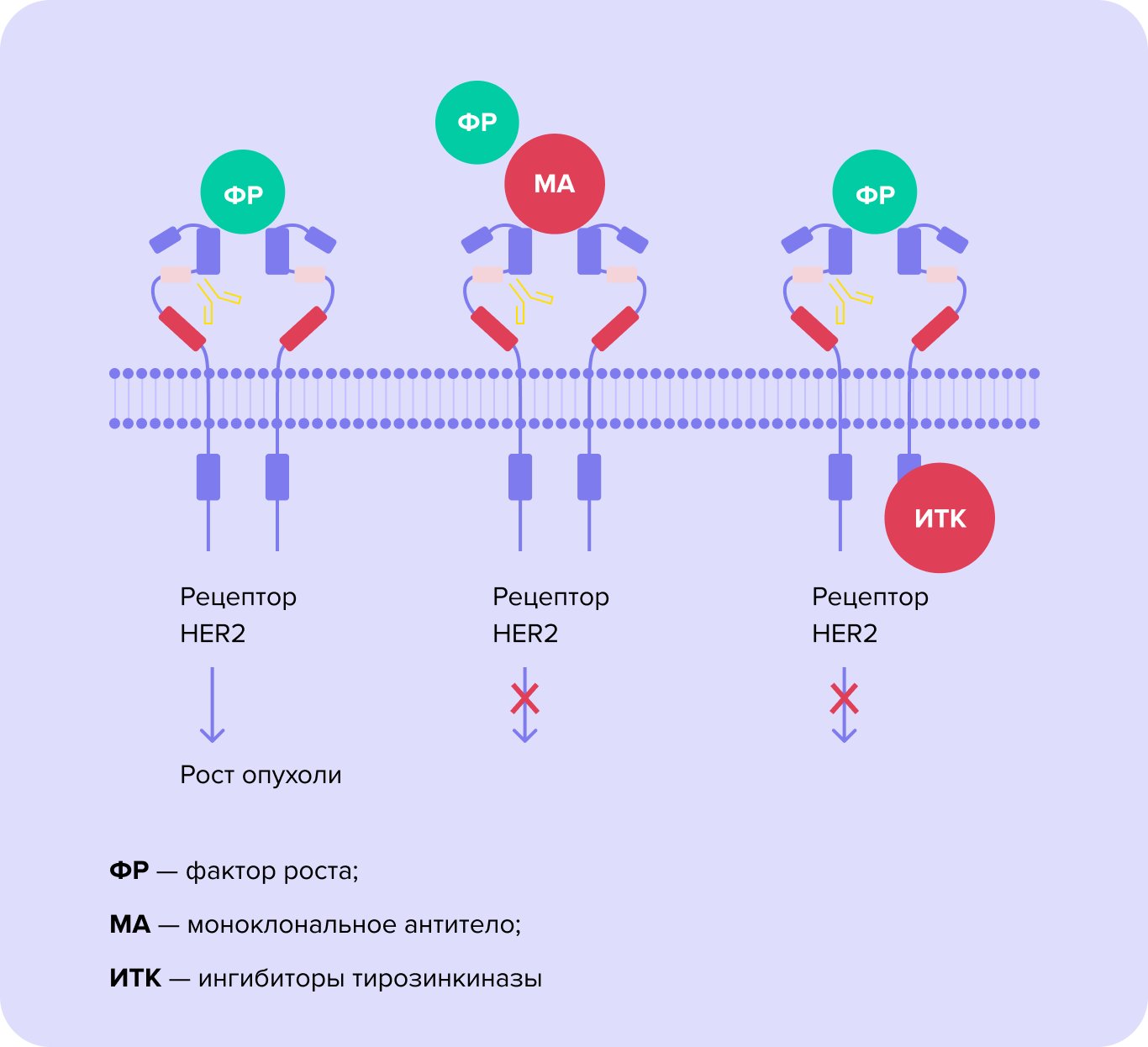
Рис. 2. Разница механизмов блокирования сигнального пути HER2
Ингибиторы CDK4/6
Циклинзависимые киназы (CDK) — ферменты, которые регулируют клеточный цикл. Онкологам интересны две из них — CDK4 и CDK6. В нормальной клетке они образуют сложный комплекс с веществами циклинами и запускают деление клетки. При люминальном раке молочной железы отмечается повышенная выработка циклинов в раковых клетках. Это ведет к постоянной активности комплекса CDK4/6 — циклин, заставляя клетку бесконечно делиться. Чтобы прервать этот механизм, используют ингибиторы CDK4/68. Препараты применяют преимущественно у пациенток с метастатическим люминальным раком молочной железы4.
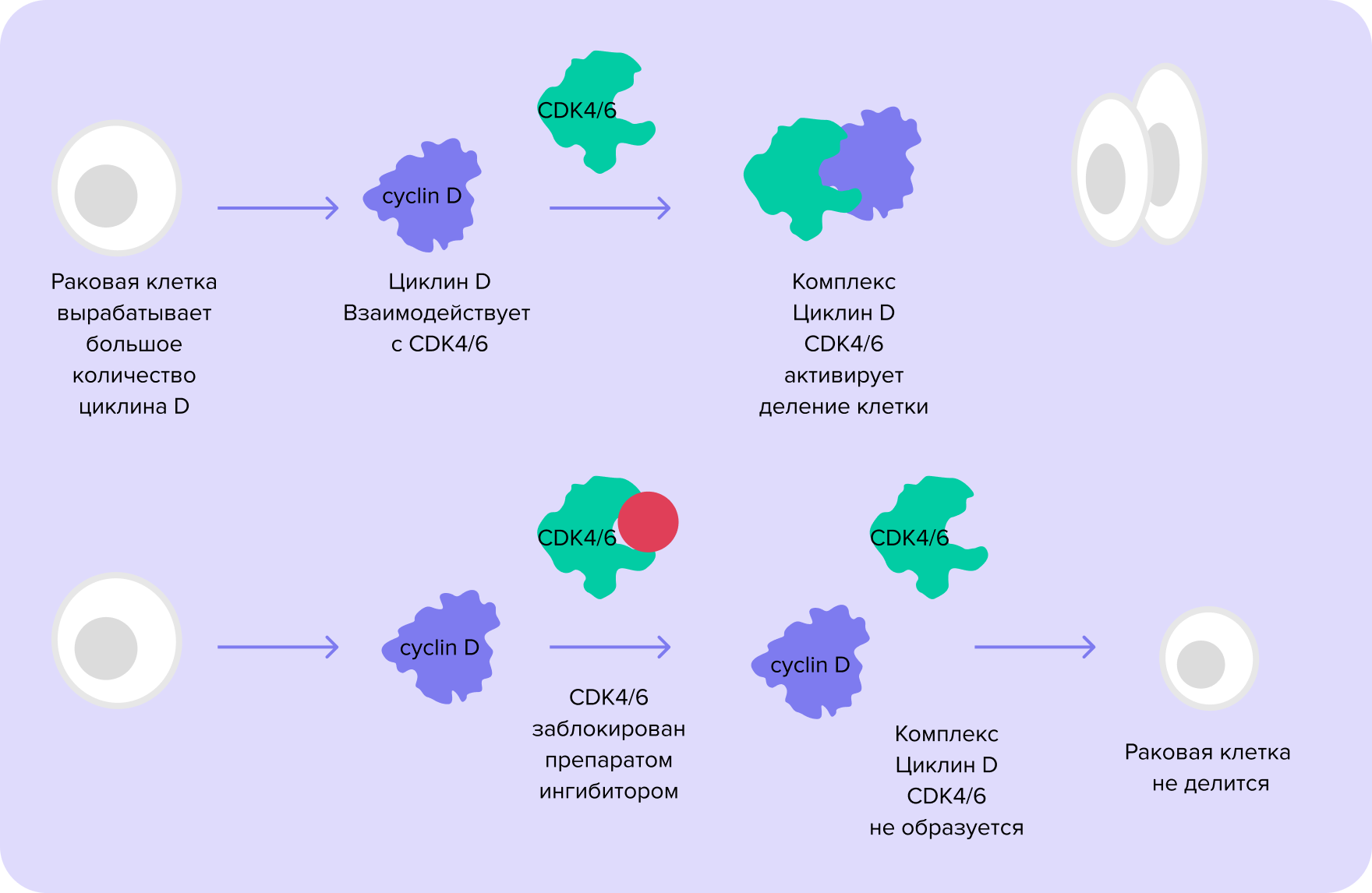
Рис. 3. Механизм противоопухолевого действия ингибиторов CDK4/68
Ингибиторы PI3K
Фосфатидилинозитол-3-киназа (PI3K) — еще одна тирозинкиназа, включенная в процесс регуляции жизненного цикла клетки. Она входит в сигнальный путь, передающий сигналы от факторов роста к клетке.
Из-за мутации в кодирующем ее гене PIK3CA тирозинкиназа находится в постоянно активированном состоянии, впоследствии заставляет клетку делиться. Примерно при 40% случаев люминального рака молочной железы обнаруживается повышенная активность PI3K8.
Препараты этого класса обычно назначают пациентам с метастатическим люминальным раком молочной железы. Для этого необходимо подтвердить наличие мутации методами молекулярно-генетической диагностики4.
Как работает анти-HER2 терапия?
Первая статья, описывающая роль HER2 в развитии рака молочной железы была опубликована в 1989 году. С тех пор постоянно накапливались данные о строении рецептора, сигнальных путях, течении заболевания. Сегодня онкологи используют более пяти различных препаратов для лечения операбельного и метастатического РМЖ.
Роль белка HER2 в развитии рака молочной железы
В норме клетки молочной железы содержат небольшое количество рецепторов HER2, которые принимают участие в процессах клеточного деления. При HER2-позитивном РМЖ в опухолевой клетке начинает формироваться избыточное количество этих рецепторов. Из-за этого раковая клетка постоянно получает сигналы к росту и делению.
Доброкачественные клетки молочной железы содержат две копии гена (ERBB2), отвечающего за образование HER2. При РМЖ происходят изменения на молекулярном уровне, в результате которых формируется множество копий гена, отвечающего за синтез рецептора HER23. Этот процесс называется амплификацией. В результате опухолевая клетка производит большое количество копий рецептора на своей поверхности (гиперэкспрессия HER2).
На сегодняшний день, чтобы определить наличие избыточного количества HER2 на опухолевых клетках, врачи проводят иммуногистохимическое исследование кусочка ткани, полученного во время биопсии. Кроме того, возможно проведение молекулярно‑генетического исследования для определения количества копий гена ERBB2. Нужно это для того, чтобы ответить на вопросы: содержат ли опухолевые клетки рецептор HER2 и будет ли таргетная терапия эффективна?
Механизмы действия анти-HER2 препаратов
Цель терапии — заблокировать передачу сигнала от рецептора HER2 к ядру клетки, что приведет к торможению ее роста и деления. Для этого используют моноклональные антитела и ингибиторы тирозинкиназ9.
Результаты и перспективы использования анти-HER2 терапии
Анти-HER2 терапия в комбинации с химиотерапией — наиболее эффективная лекарственная опция у пациентов с HER2-положительным РМЖ. Ее использование связано с увеличением периода времени без прогрессирования заболевания и продолжительности жизни10, 11.
Таргетная терапия трижды негативного рака молочной железы
При этом типе РМЖ на поверхности раковых клеток нет рецепторов ни к половым гормонам, ни к HER2. Онкологи ограничены в выборе лечения и могут применять только химиотерапию. Однако у четверти пациентов с трижды негативным раком имеется мутация BRCA1/2. При ней отключаются механизмы восстановления ДНК, что впоследствии приводит к накоплению генетических нарушений. Для пациентов с подтвержденной мутацией BRCA1/2 применяются ингибиторы PARP. Они вызывают критические нарушения в структуре ДНК и гибель опухолевых клеток. Здоровым клеткам ингибиторы PARP не причиняют вреда, поскольку в них работают те самые механизмы защиты ДНК, которых нет у клетки с мутацией генов BRCA 1 и 212.
Будущее онкологии в персонализации лечения. При таком подходе каждый пациент получает терапию в зависимости от биологических особенностей раковых клеток и генетических причин заболевания. Поэтому с развитием таргетной терапии и поиском новых молекулярных мишеней связаны надежды на совершенствование методов лечения рака.
M-RU-00014686 Январь 2024
Источники
- Meisel J.L., et al. Evolution of targeted therapy in breast cancer: where precision medicine began. American Society of Clinical Oncology Educational Book. 2018 May 23;38:78–86. (Электронный ресурс). URL: https://ascopubs.org/doi/10.1200/EDBK_201037 (дата обращения: 15.12.2023).
- Jacobs A.T., et al. Targeted therapy for breast cancer: An overview of drug classes and outcomes. Biochemical Pharmacology. 2022 Oct;204:115209. (Электронный ресурс). URL: https://doi.org/10.1016/j.bcp.2022.115209 (дата обращения: 15.12.2023).
- Iacopetta D., et al. Targeting breast cancer: An overlook on current strategies. International Journal of Molecular Sciences. 2023 Feb 11;24(4):3643. (Электронный ресурс). URL: https://www.mdpi.com/1422-0067/24/4/3643 (дата обращения: 15.12.2023).
- Клинические рекомендации. Рак молочной железы. 2021. (Электронный ресурс). URL: https://cr.minzdrav.gov.ru/recomend/379_4 (дата обращения: 15.12.2023).
- De Abreu F.B., et al. Personalized therapy for breast cancer. Clinical genetics. 2014 Jul;86(1):62–67. (Электронный ресурс). URL: https://doi.org/10.1111/cge.12381 (дата обращения: 15.12.2023).
- Переводчикова Н.И. Таргетные препараты и их место в современной терапии опухолевых заболеваний. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2009;2(4);367–373.
- Thomson R.J., Moshirfar M., Ronquillo Y. Tyrosine kinase inhibitors. StatPearls [Internet]. StatPearls Publishing. 2023. (Электронный ресурс). URL: https://www.ncbi.nlm.nih.gov/books/NBK563322/ (дата обращения: 15.12.2023).
- Lau K.H., Tan A.M., Shi Y. New and emerging targeted therapies for advanced breast cancer. International Journal of Molecular Sciences. 2022 Feb 18;23(4):2288. (Электронный ресурс). URL: https://doi.org/10.3390/ijms23042288 (дата обращения: 15.12.2023).
- Официальный сайт Американского онкологического общества. Targeted Drug Therapy for Breast Cancer. (Электронный ресурс). URL: https://www.cancer.org/cancer/breast-cancer/treatment/targeted-therapy-for-breast-cancer.html (дата обращения: 01.08.2023).
- Yao M., Fu P. Advances in anti-HER2 therapy in metastatic breast cancer. Chinese Clinical Oncology. 2018 Jun;7(3):27. (Электронный ресурс). URL: https://cco.amegroups.org/article/view/20028/19895 (дата обращения: 15.12.2023).
- Mohamed A., et al. Targeted therapy for breast cancer. The American journal of pathology. 2013 Oct;183(4):1096–1112. (Электронный ресурс). URL: https://doi.org/10.1016/j.ajpath.2013.07.005 (дата обращения: 15.12.2023).
- Cetinkaya D.B., Avci C.B. Molecular perspective on targeted therapy in breast cancer: a review of current status. Medical Oncology. 2022 Jul 14;39(10):149. (Электронный ресурс). URL: https://link.springer.com/article/10.1007/s12032-022-01749-1 (дата обращения: 15.12.2023).




