Время прочтения: 17 минут
Содержание:
- Введение
- Особенности диагностики
- Клинические проявления и симптомы
- Диагностические методы исследования
- Предоперационная терапия
- Цели и принципы предоперационной терапии
- Типы предоперационной терапии
- Эффективность предоперационной терапии в ТНРМЖ
- Оперативное лечение
- Виды операций в лечении ТНРМЖ
- Роль реконструктивной хирургии
- Важность лимфодиссекции в предотвращении рецидивов
- Послеоперационное лечение
- Химиотерапия и ее роль после операции
- Радиотерапия и ее влияние на рецидивы и выживаемость
- Роль таргетной терапии в послеоперационном лечении
- Новые подходы к лечению метастатических и рецидивирующих форм ТНРМЖ
- Основные вызовы при лечении метастатических и рецидивирующих форм ТНРМЖ
- Клинические исследования и перспективы лечения ТНРМЖ
Введение
Рак молочной железы — это группа онкологических заболеваний, развивающихся в молочной железе. Опухоли молочной железы отличаются по внешнему виду, активности, строению опухолевых клеток, способности вырабатывать молекулы-рецепторы. Для установления конкретного вида заболевания врачи проводят исследование клеток новообразования. Они описывают их внешний вид и расположение, определяют количество рецепторов к эстрогену, прогестерону, эпидермальному фактору роста 2-го типа (HER2), чтобы выбрать наиболее эффективное лечение. Опухоль, клетки которой содержат рецепторы к эстрогену и прогестерону, с большой вероятностью уменьшится под действием гормональной терапии, при обнаружении HER2 врачи применят таргетную терапию.

На долю тройного негативного рака молочной железы приходится 15–25% всех случаев рака молочной железы1. Как правило, для этого подтипа характерна высокая скорость деления клеток, на которую указывает большое значение индекса Ki-67 (показателя активности деления опухолевых клеток), что приводит к высокой активности и быстрому росту1.
Особенности диагностики
Как и при других онкологических заболеваниях молочной железы, врач для начала проводит осмотр и анализирует жалобы. При возникновении подозрений на онкологическое заболевание он назначит диагностику, включающую визуализацию опухоли и определение ее биологического типа2.
Клинические проявления и симптомы
Трижды негативный рак молочной железы по своим симптомам и клиническим проявлениям не отличается от других злокачественных опухолей этого органа. В ткани железы появляется плотное образование — узелок, который можно почувствовать через кожу. Над опухолью кожа может втягиваться, образуя ямочку. Возможно изменение формы соска, он как бы проваливается вовнутрь. При распространении заболевания увеличиваются подмышечные лимфатические узлы2. Если вы обнаружили у себя изменения — обратитесь к врачу, не откладывая. Однако внешние признаки возникают при увеличении размера новообразования, поэтому самообследование на заменяет регулярную маммографию, которая может выявить новообразование на более ранних стадиях3.
Диагностические методы и исследования

Само по себе выявление новообразования при осмотре или на маммографии еще не говорит о том, что это рак. Определить это можно, только изучив образец опухоли, полученный во время биопсии. Исследование проводит врач-патолог. Он изучает опухоль под микроскопом и описывает особенности ее строения. Обязательным является определение количества рецепторов к эстрогену, прогестерону, рецептора HER2 и антигена Ki-67. Эти данные необходимы для установления точного диагноза и выбора метода лечения. При метастатическом трижды негативном раке молочной железы патолог также определяет количество лиганда програмируемой клеточной гибели (PD-L1), чтобы определить, будет ли эффективна иммунотерапия2.
Генетическое исследование требуется пациенткам, у которых заболевание развилось до наступления 60 лет. У них исследуются гены BRCA1/2, мутации которых говорят о наследственной предрасположенности к раку молочной железы и яичников2.
Предоперационная терапия
Как и при других типах опухолей молочной железы, при трижды негативном раке основа лечения — хирургическая операция. Ее выполняют всем пациентам без метастазов в отдаленные органы. В дополнение к операции врачи применяют лекарственные препараты, которые уничтожают клетки, отсоединившиеся от опухоли, но еще не превратившиеся в метастазы. Если такая терапия проводится до операции она называется предоперационной, или неоадъювантной, если после — послеоперационной, или адъювантной.
Трижды негативный рак молочной железы высоко агрессивен, т. е. он быстро растет и распространяется по организму. Поэтому у всех пациентов со II и III стадиями заболевания лечение начинают с неоадъювантной терапии.
Цели и принципы предоперационной терапии
Назначая лекарственную терапию до операции, врач решает несколько задач:
- Борьба с микрометастазами — отдельными опухолевыми клетками, оторвавшимися от основного образования, но еще не сформировавшими новый очаг. Ни один метод исследования не может обнаружить, где и сколько таких отсевов произошло. Уничтожить их можно только с помощью лекарственной терапии, которая действует во всем организме.
- Уменьшение размера новообразования — в результате ранее неоперабельные образования становятся доступными для хирургического лечения. Уменьшение объема опухолей, которые и так можно было удалить, позволяет хирургу провести органосберегающую операцию с сохранением молочной железы.
- Определение прогноза заболевания и тактики лечения можно сделать по результатам предоперационной терапии. Каждая опухоль обладает индивидуальными особенностями, что объясняет разную эффективность одного и того же лечения даже у пациентов с одинаковым типом рака. В зависимости от результата предоперационной терапии врач поймет, насколько высок риск возвращения опухоли (рецидива) после операции и как его уменьшить4.
Типы предоперационной терапии
При трижды негативном раке молочной железы используется предоперационная химиотерапия, которая показывает высокую эффективность при данном типе опухоли. После завершения терапии и проведенной после нее операции врач-патоморфолог изучает удаленные ткани и оценивает, насколько успешно сработали противоопухолевые препараты.
Эффективность предоперационной терапии в ТНРМЖ
В ряде случаев на фоне лекарственного лечения происходит полное исчезновение опухоли или полный патоморфологический ответ. Это становится понятно, когда в удаленной при операции ткани врач-патоморфолог не находит раковых клеток.

Если же исследование показывает, что полный лечебный патоморфоз не достигнут, то после операции могут потребоваться дополнительные курсы лекарственной терапии2.
Оперативное лечение
Хирургическое удаление новообразования — один из основных методов лечения трижды негативного рака молочной железы. От операции приходится отказаться только в двух случаях:
- при неблагоприятном расположении образования, когда вмешательство имеет риски для жизни;
- при IV стадии заболевания, когда развились метастазы в отдаленных органах.
При таких клинических ситуациях ведущим методом становится лекарственная терапия.
Объем оперативного лечения определяется размером опухоли, вовлеченностью регионарных лимфоузлов, общим состоянием, возрастом и пожеланиями пациентки2.
Виды операций в лечении ТНРМЖ
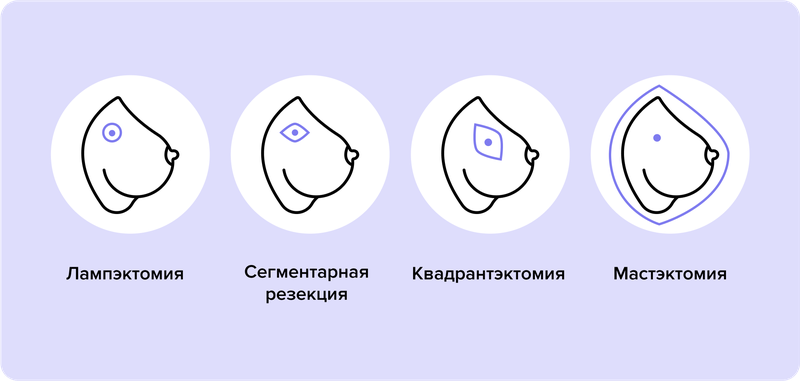
При раке молочной железы хирург может выполнить либо органосохраняющую операцию, либо мастэктомию. В первом случае удаляется только часть молочной железы, в которой расположена опухоль. В зависимости от размера новообразования подбирают вариант лечения. Вмешательство минимально при лампэктомии — прицельном удалении опухоли в пределах здоровых тканей. При увеличении размера опухоли операция расширяется. Чтобы не упустить ни одну опухолевую клетку и снизить вероятность возвращения заболевания, хирург убирает участок молочной железы большего размера. В таком случае говорят о сегментэктомии и квадрантэктомии. Преимущество органосохраняющих операций заключается в сохранении собственной молочной железы и естественного вида груди5.
Мастэктомия заключается в удалении всей молочной железы, и, если требуется, прилегающих тканей.
Роль реконструктивной хирургии
После мастэктомии естественная форма груди нарушается, что снижает качество жизни женщин, перенесших операцию. Для восстановления образа тела хирурги проводят реконструктивные операции. Они включают восстановление груди с помощью имплантов, пересадки ткани, коррекции послеоперационных рубцов. Успешная реконструктивная операция воссоздает грудь с хорошим косметическим эффектом, что снижает психологический стресс4.
Пластические операции могут проводиться во время мастэктомии, либо через некоторое время после нее. На решение о сроках влияют особенности заболевания и тактика лечения. Так, многим пациенткам после хирургического лечения требуется лучевая терапия, которая может спровоцировать расхождение швов. В этом случае лучше провести операцию вторым этапом после завершения онкологического лечения6.
Важность лимфодиссекции в предотвращении рецидивов
Лимфатические узлы располагаются по ходу лимфатических сосудов. Они представляют собой маленькие фильтры, в которых задерживаются транспортируемые лимфой клетки, в том числе и опухолевые. Поэтому подмышечные лимфатические узлы — одно из первых мест развития метастазов при раке молочной железы.
Удаление лимфатических узлов при их поражении называется лимфодиссекцией. Ее цель заключается в снижении вероятности рецидива заболевания.
Лимфодиссекция подмышечных лимфатических узлов — травматичная операция, приводящая к развитию отеков, нарушению движений в плечевом суставе и т. д. Поэтому она проводится только тогда, когда это необходимо.
Послеоперационное лечение
При выполнении операции хирург придерживается принципа радикальности, он старается удалить максимальное количество опухолевых клеток из организма. Для этого он иссекает основной опухолевый очаг, удаляет окружающие ткани и лимфатические узлы при их поражении. Однако уже на момент проведения операции по организму могут быть распространены отдельные раковые клетки — микрометастазы, которые еще никак себя не проявили. Для их уничтожения применяется послеоперационное, или адъювантное, лечение7.
При тройном негативном раке молочной железы после хирургической операции онкологи назначают химиотерапию, лучевую и таргетную терапии.

Химиотерапия и ее роль после операции
Послеоперационная химиотерапия применяется при высоком риске рецидива заболевания. В частности, у пациентов, у которых на этапе предоперационной химиотерапии не удалось достичь полного патоморфологического ответа из-за устойчивости некоторых опухолевых клеток к препаратам. Чтобы справиться с ними на послеоперационном этапе, врач снова применяет химиотерапевтические препараты, но уже с другим механизмом действия. Адъювантную терапию обычно начинают в течение 4–6 недель после операции. Затягивать со сроками нельзя. Позже, чем через 3 месяца после операции такое лечение обычно не назначают, поскольку это нецелесообразно.

Радиотерапия и ее влияние на рецидивы и выживаемость
Радиотерапия также входит в состав комплексного лечения трижды негативного рака молочной железы. Врач радиотерапевт с помощью ионизирующего излучения воздействует локально на место, где высока вероятность сохранения опухолевых клеток. После операции облучение бывшего расположения опухоли «добивает» сохранившиеся раковые клетки, что дополнительно уменьшает вероятность рецидива и улучшает прогноз заболевания8.

Роль таргетной терапии в послеоперационном лечении
Рак возникает, когда происходит сбой регуляции роста и деления клеток. Причиной этого нарушения являются генетические изменения — мутации. При некоторых опухолях ученые установили точный ген, нарушение которого приводит к раку и разработали препараты подавляющие мутировавшие клетки.
В 3% случаев развитие рака молочной железы связано с наследственной мутацией генов BRCA 1 и 22. При их изменении нарушаются процессы восстановления ДНК, в результате чего накапливаются генетические ошибки, приводящие к раку.
У пациенток с трижды негативным раком молочной железы частота мутации BRCA1/2 выше, чем при других опухолях молочной железы и достигает 25%9. Поэтому все пациентки с этим заболеванием должны пройти молекулярно-генетическое исследование для поиска генетических нарушений2.
Обнаружение генов BRCA1/2 в образце опухоли позволяет назначить таргетную терапию ингибитором PARP. Препарат вызывает гибель мутировавших клеток, в которых были нарушены процессы восстановления ДНК. Ингибиторы PARP помогают снизить риск рецидива заболевания и увеличить выживаемость10.
Новые подходы к лечению метастатических и рецидивирующих форм ТНРМЖ
При развитии метастазов в органах врачи говорят о раке IV стадии, или метастатическом раке. В этом случае операция не позволяет излечить пациента, поскольку опухоль уже распространилась по организму. Главным методом лечения становится лекарственная терапия, которая может уничтожить клетку опухоли, где бы она не находилась. При трижды негативном метастатическом раке молочной железы для этого применятся химиотерапия. Препараты оказывают токсическое действие на быстро делящиеся клетки, вызывая их гибель. Однако эффективность этого подхода ограничена — некоторые клетки будут изначально не чувствительны к лечению, другие со временем приобретут устойчивость.
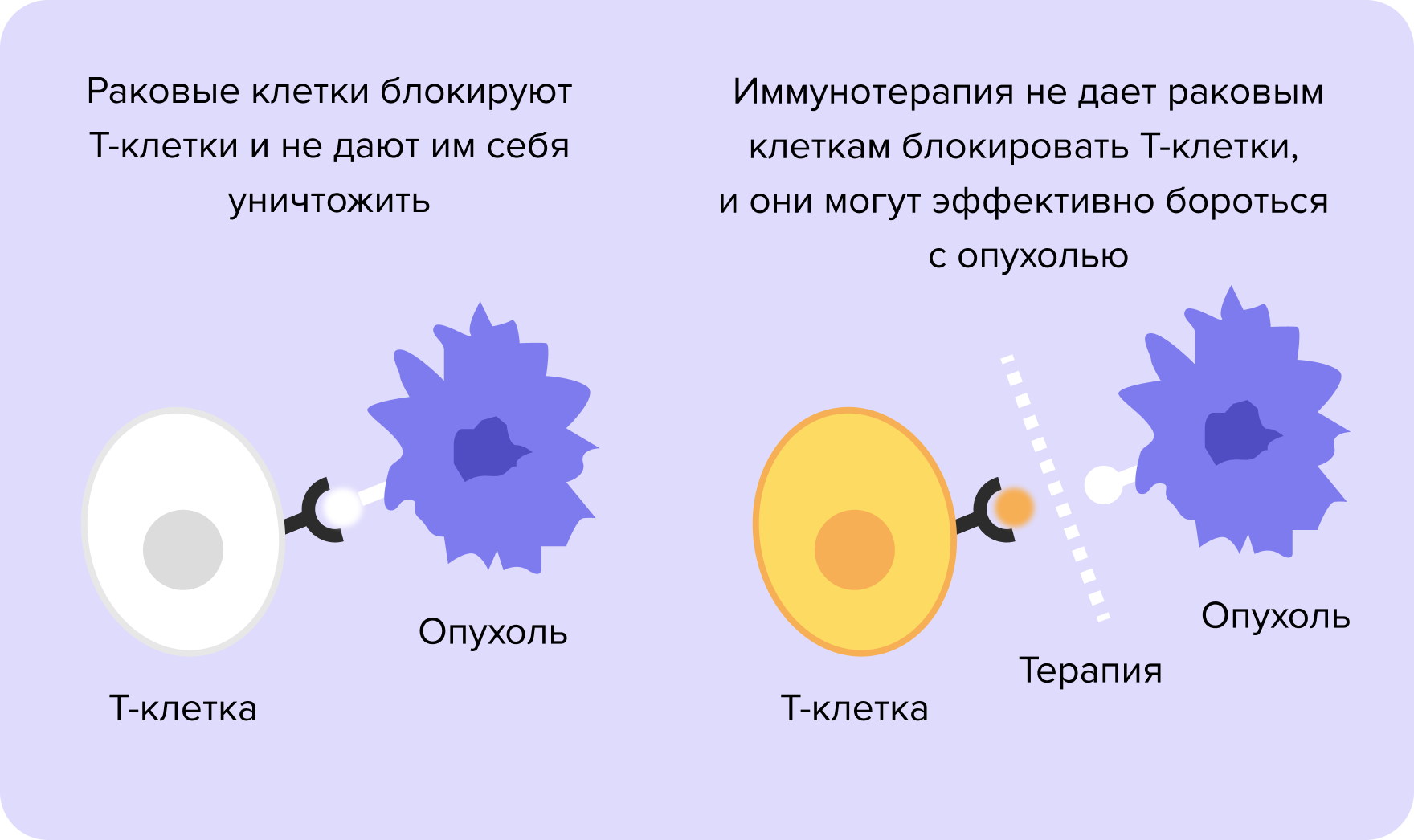
Рис. 1. Как работает иммунотерапия при раке
Дополнительные возможности дает иммунотерапия. В норме иммунная система осуществляет так называемый иммунный надзор, своевременно распознавая и уничтожая все опухолевые клетки. Однако иногда система может давать сбой. Опухоли умеют обманывать иммунитет и становиться невидимыми для него. Один из способов — производство и выставление на своей поверхности белка PD-L1, который служит щитом и способствует ускользанию опухоли от естественных защитных сил организма11.
Иммунотерапия блокирует PD-L1, после чего собственный иммунитет человека обнаруживает и уничтожает раковые клетки. При метастатическом тройном негативном раке молочной железы для назначения иммунотерапии нужно определить количество PD-L1 в образце опухоли12.
При метастатическом раке также используется таргетная терапия PARP-ингибиторами при выявлении мутации генов BRCA 1 и 213.
Основные вызовы при лечении метастатических и рецидивирующих форм ТНРМЖ
Врачи испытывают сложности с лечением трижды негативного рака молочной железы из-за невозможности использования гормональной и анти-HER2 терапии. Единственным вариантом остается назначение химиотерапии. Опухоль хорошо отвечает на химиопрепараты, однако часто развивает устойчивость, что приводит к рецидивам заболевания. Помочь в лечении пациентов может изучение глубинных клеточных механизмов развития опухоли, поиск новых мишеней для таргетной терапии, разработка новых химиотерапевтических препаратов.
Клинические исследования и перспективы лечения ТНРМЖ
Иммунотерапия и таргетная терапия подходит не всем пациенткам с трижды негативным раком молочной железы. Для их назначения требуется выявление мутации генов BRCA 1 и 2 и определение повышенного уровня PD-L1. Для многих женщин единственным вариантом лечения остается химиотерапия, применение которой сопровождается большим количеством побочных эффектов. Более того, на поздних стадиях и при рецидивах заболевания ее эффективность ограничена.
Для поиска новых механизмов образования этой опухоли проводятся клинические исследования. Понимание биологии процесса помогает ученым разрабатывать препараты, прерывающие цепь событий и предотвращающие деление опухолевых клеток.
По состоянию на 2023 год в мире проходит около 100 исследований новых терапевтических схем лечения трижды негативного рака молочной железы14.
Будущее онкологии — в применении персонализированного лечения. При этом подходе врач сможет провести точную диагностику генетических нарушений, вызвавших злокачественное перерождение, и подобрать терапию11.
M-RU-00014368 Декабрь 2023
Источники
- Almansour N.M. Triple-negative breast cancer: a brief review about epidemiology, risk factors, signaling pathways, treatment and role of artificial intelligence. Frontiers in Molecular Biosciences. 2022 Jan;9. (Электронный ресурс). URL: 10.3389/fmolb.2022.836417 (дата обращения: 04.12.2023).
- Клинические рекомендации Минздрава РФ. Рак молочной железы. 2021. (Электронный ресурс). URL: https://cr.minzdrav.gov.ru/recomend/379_4 (дата обращения: 05.12.2023).
- Birhane K., Alemayehu M., et al. Practices of Breast Self-Examination and Associated Factors among Female Debre Berhan University Students. International Journal of Breast Cancer. 2017. (Электронный ресурс). URL: https://doi.org/10.1155/2017/8026297 (дата обращения: 04.12.2023).
- Van den Ende N.S., Nguyen A.H., et al. Triple-Negative Breast Cancer and Predictive Markers of Response to Neoadjuvant Chemotherapy: A Systematic Review. International Journal of Molecular Sciences. 2023;24(3): 2969. (Электронный ресурс). URL: https://doi.org/10.3390/ijms24032969 (дата обращения: 04.12.2023).
- Sun Z.-H., Chen C., et al. Breast surgery for young women with early-stage breast cancer: Mastectomy or breast-conserving therapy? Medicine. 2021 May;100(18):e24480. (Электронный ресурс). URL:
https://journals.lww.com/md-journal/fulltext/2021/05070/breast_surgery_for_young_women_with_early_stage.90.aspx (дата обращения: 04.12.2023). - Regan J.-P., Schaffner A.D. Breast Reconstruction Expander Implant. National Library of Medicine. 2022. (Электронный ресурс). URL: https://www.ncbi.nlm.nih.gov/books/NBK431062 (дата обращения: 04.12.2023).
- Тюляндин С.А. и др. Практические рекомендации по лекарственному лечению рака молочной железы. Рак молочной железы. Практические рекомендации RUSSCO. 2021. DOI: 10.18027/2224-5057-2021-11-3s2-09.
- He M.Y., et al. Radiotherapy in triple-negative breast cancer: Current situation and upcoming strategies. Critical Reviews in Oncology/Hematology. 2018;131:96–101. (Электронный ресурс). URL: https://doi.org/10.1016/j.critrevonc.2018.09.004 (дата обращения: 05.12.2023).
- Pavese F., et al. BRCA mutation status in triple-negative breast cancer patients treated with neoadjuvant chemotherapy: a pivotal role for treatment decision-making. Cancers. 2022;14(19):4571. (Электронный ресурс). URL: https://doi.org/10.3390/cancers14194571 (дата обращения: 05.12.2023).
- Li Y., et al. Targeted therapeutic strategies for triple-negative breast cancer. Frontiers in oncology. 2021;11:731535. (Электронный ресурс). URL: https://doi.org/10.3389/fonc.2021.731535 (дата обращения: 05.12.2023).
- Won K.‑A., Spruck Ch. Triple‑negative breast cancer therapy: Current and future perspectives. International journal of oncology. 2020 Dec;57(6):1245–1261. (Электронный ресурс). URL: https://doi.org/10.3892/ijo.2020.5135 (дата обращения: 05.12.2023).
- Liang X., et al. Immune checkpoint inhibitors in first-line therapies of metastatic or early triple-negative breast cancer: a systematic review and network meta-analysis. Frontiers in Endocrinology. 2023;14:1137464. (Электронный ресурс). URL: https://doi.org/10.3389/fendo.2023.1137464 (дата обращения: 05.12.2023).
- Li Sh., et al. Current therapeutic strategies for metastatic triple-negative breast cancer: From pharmacists’ perspective. Journal of Clinical Medicine. 2022;11(20):6021. (Электронный ресурс). URL: https://doi.org/10.3390/jcm11206021 (дата обращения: 05.12.2023).
- ClinicalTrials.gov. (Электронный ресурс). URL: https://clinicaltrials.gov/search?cond=Triple%20Negative%20Breast%20Cancer&term=Triple-Negative%20Breast%20Carcinoma&aggFilters=phase:3,studyType:int&page=3 (дата обращения: 05.12.2023).




